Kekuatan Asam Basa
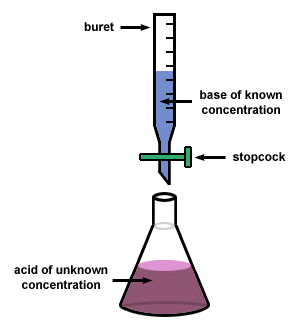

Kekuatan Asam Basa | Materi Kimia Kelas XI SMA
Asam Basa – Dalam mempelajari asam-basa
maka kita tidak luput dihadapkan pada seberapa kuat suatu asam dan basa.
Apakah suatu zat bersifat sebagai asam kuat, asam lemah atau basa kuat,
lalu bagaimanakah kita dapat menentukan kekuatan asam atau kekuatan
basa suatu zat?
Yang menjadi penentu kekuatan asam atau
basa adalah adalah posisi kesetimbangan reaksi disosiasi asam atau basa
dalam air. Sebagai contoh suatau HA dalam air akan mengalami reaksi
disosiasi sebagai berikut:
HA + H2O <-> H3O+ + A-
Asam kuat adalah zat dimana reaksi
kesetimbangan disosiasinya mengarah jauh ke arah kanan, akibatnya pada
keadaan setimbang hampir seluruh asam HA terdisosiasi menjadi H3O+ dan
A-. Materi Asam Basa
Sedngakan asam lemah berkebalikan dengan
asam kuat yaitu reaksi kesetimbangan disosiasinya mengarah jauh ke arah
kiri, jadi sangat sedikit sekali HA yang akan terdisosiasi menjadi H3O+
dan A-.
Untuk menentukan besarnya kekuatan asam
yang satu dengan yang lainnya maka kita bisa mengukur harga Ka-nya
(Konstanta disosiasi asam) yang dihitung dengan menggunakan rumus
sebagai berikut:
HA + H2O <-> H3O+ + A-
Ka = [H3O+][A-] / [HA][H2O]
Rumus diatas dapat disederhanakan menjadi:
Ka = [H+][A-] / [HA]
Yang perlu diperhatikan bahwa H+ diatas
mewakili H3O+. Ka adalah tetapan kesetimbangan asam oleh karena itu
nilainya sangat dipengaruhi oleh temperatur. Semakin kecil nilai Ka
mengindikasikan bahwa asam tersebut adalah asam lemah begitu juga
sebaliknya.
Lalu mengapa dibuku-buku pelajaran kimia
hanya asam lemah saja yang memiliki nilai Ka sedangakan asam kuat tidak
memiliki nilai Ka?
Sebenarnya asam kuat juga memiliki nilai
Ka, akan tetapi nilai Ka asam kuat sangat sulit diukur secara tepat
disebabkan kita tidak bisa menghitung secara pasti konsentrasi HA pada
kondisi setimbang. Ingat bahwa asam kuat kesetimbangannya jauh ke arah
kanan sehingga besarnya konsentrasi HA yang tidak terdisosiasi sukar
untuk ditentukan.
Bagaimana dengan basa?
Materi Asam Basa – Untuk basa hal yang
sama seperti diatas dapat diterapkan, missal suatau basa BOH akan
terdisosiasi dalam air sebagai berikut:
BOH <-> B+ + OH-
Dan tetapan disosiasi basanya adalah sebagai berikut:
Kb = [B+][OH-] / [BOH]
Berbeda dengan asam tetapan disosiasi
basa dilambangan dengan Kb (huruf a dan b pada lambang tetapan disosiasi
asam dan basa menyatakan a untuk acid yaitu asam dan b untuk base atau
basa).
Sekali lagi Ka dan Kb adalah tetapan
kesetimbangan khusus yang menunjukan reaksi disosiasi asam dan basa
dalam larutan air. Seperti halnya harga tetapan kesetimbangan yang lain
maka nilai Ka dan Kb sangat dipengaruhi oleh temperatur.
Tabel Kekuatan Asam
| Asam Kuat | Asam Lemah |
| HCl | CH3COOH |
| H2SO4 | H2CO3 |
| HNO3 | H2S |
| HBr | HCN |
| HI | HCOOH |
| HClO4 | dll |
| dll |
Tabel Kekuatan Basa
| Basa Kuat | Basa Lemah |
| NaOH | NH4OH |
| KOH | |
| Ba(OH)2 | |
| Sr(OH)2 | |
| Ca(OH)2 | |
| Mg(OH)2 | |
| Semua basa dari golongan IA dan IIA,kecuali Be(OH)2 |




